НАУЧНО-ПРАКТИЧЕСКАЯ КОНФЕРЕНЦИЯ
“ЛЕЧЕНИЕ ИШЕМИИ МОЗГА”
10 ДЕКАБРЯ 2001
РОССИЯ, МОСКВА

Современная концепция патогенеза и лечения острой ишемии мозга
А.И. Федин
профессор, заведующий кафедрой неврологии и нейрохирургии ФУВ РГМУ,
заслуженный врач Российской Федерации 
Уважаемые коллеги,
настоящее сообщение посвящено острой ишемии, сопровождающейся инфарктом мозга. Статистика инсультов весьма удручающая для нашей страны, Это касается распространенности инсульта и смертности от него. Среди европейских стран по этим показателям наша страна на втором месте (впереди только Болгария). Последствия инсульта всем хорошо известны. Инвалидность с потерей трудоспособности по разным данным составляет от 40 до 80%. Единой статистики по этому вопросу в нашей стране нет.
 |
Рис. 1. Подтипы инфаркта мозга |
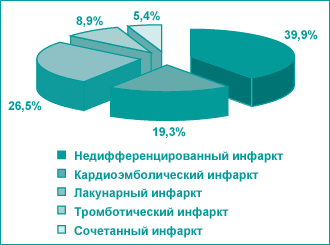 |
Когда мы говорим о патогенетическом обосновании лечения острой ишемии мозга, мы должны представлять, что инфаркт мозга как нозологическая группа полиморфна и имеет различные подтипы (рис. 1). Почти 40% инфарктов мозга не дифференцированы по своему происхождению, то есть мы не знаем тромбоз это или эмболия, поскольку нет надежных методов диагностики. Особенно это касается мелких артерий, которые не доступны для ангиографии и в таких случаях наше суждение является предположительным.
Очень большая доля принадлежит лакунарным инфарктам — 26,1%. Кардиоэмболические инфаркты составляют 19%. По другой статистике до 30% ишемических инсультов — это кардиоэмболические осложнения. Геморрагический инфаркт — 9% и сочетанные инфаркты — около 5,5%. Вот основные подтипы инфарктов. Эта статистика достаточно условна, так как клинические исследования, проведенные на большом и верифицированном клиническом материале, отсутствуют. При общей нозологической форме инфаркта мозга эти подтипы влияют на клинические проявления и характер проводимого лечения, поскольку эмболия и тромбоз — это два состояния разные по патогенезу и в этих случаях могут быть разные клинические подходы.
Среди этиологических факторов наибольшее значение имеют атеросклероз и гипертоническая болезнь как наиболее значимые сосудистые заболеваниям. Не следует забывать об экстравазальных компрессиях, особенно компрессиях позвоночных артерий в области шеи при дегенеративных изменениях в позвоночнике. В результате компрессий возникает редукция мозгового кровотока, которая вызывает развитие последующей ишемии мозга. Среди основных причин кардиогенных эмболии — мерцательная аритмия различной этиологии, инфаркт миокарда и его последствия, эндокардит, кардиомиопатия. Эти факторы наиболее угрожаемы для развития инсульта и имен но мерцательная аритмия является самым значимым фактором риска развития ишемического инсульта.
Причиной острой ишемии является редукция мозгового кровотока. Как известно, в норме мозговой кровоток составляет 50-55 мл в минуту на 100 грамм вещества мозга. Весь запас питательных веществ экстрагируется из крови. При этом из крови экстрагируется 50% кислорода и 10% глюкозы. Очень большой объем вырабатываемой энергии направляется на поддержание энергетического метаболизма, а остальная часть расходуется на высвобождение и функционирование нейромедиаторов и клеточных структур мозга.
В настоящее время достаточно хорошо изучены критические уровни мозгового кровотока. Механизмы ауторегуляции мозгового кровотока осуществляются в соответствии с уровнем артериального давления. Существуют также метаболический и нейрогенный контроль регуляции, что обеспечивает в итоге поддержание и постоянство перфузионного давления в артериях головного мозга. Это очень важно для функционирования головного мозга. Но там, где есть редукция и ограничение кровотока, снижается его тканевый объем.
Выделяют несколько степеней критических уровней реакции тканей головного мозга на это снижение. При первом уровне снижения (кровоток менее 50 мл/100 грамм ткани мозга/мин), происходит снижение синтеза белков и экспрессии генов. При втором уровне происходит активация анаэробного гликолиза, увеличение экстракции из крови лактата, развитие лактацидоза вплоть до развития токсического отека мозга. Второй уровень наблюдается при глубокой ишемии мозга (снижение объемного кровотока до 30 мл/100 грамм ткани мозга/мин) и она уже становится значимой при данной патологии.
Третий уровень (снижение объемного кровотока до 20 мл/100 грамм ткани мозга/мин) наиболее изученный, при этом отмечается дестабилизация клеточных мембран, нарушения каналов ионного транспорта, высвобождение избыточно возбуждающих нейротрансмиттеров. Особое значение при этом придается глутаматному выбросу.
Химическая нейромедиация происходит в области синапсов, пресинаптического и постсинаптического нейронов. В синаптической щели работает нейромедиатор, который переводит электрический сигнал в химический (рис. 2). Таким образом, происходит химическая нейротрансмиссия.
| Рис. 2. Структуры синапса |
 |
Рис. 3. Глутаматные рецепторы |
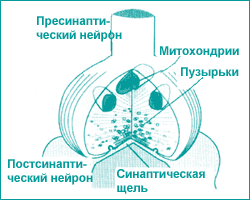
 Аксональная терминаль пресинаптического нейрона формирует синапс с постсинаптическим нейроном. Энергия для функционирования синапса вырабатывается митохондриями пресинаптического нейрона. Химический нейротрансмиттер локализуется в маленьком пузырьке и высвобождается из него при возбуждении. Синаптическая щель находится между пресинаптическим и постсинаптическим нейронами. Рецепторы располагаются по обе стороны щели. Аксональная терминаль пресинаптического нейрона формирует синапс с постсинаптическим нейроном. Энергия для функционирования синапса вырабатывается митохондриями пресинаптического нейрона. Химический нейротрансмиттер локализуется в маленьком пузырьке и высвобождается из него при возбуждении. Синаптическая щель находится между пресинаптическим и постсинаптическим нейронами. Рецепторы располагаются по обе стороны щели. |
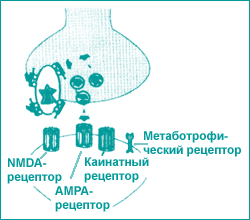
Выделяют 5 типов глутаматных рецепторов. Наиболее изученными являются NMDA- и AMPA-рецепторы. При ишемическом каскаде экзайтоксичность связана с дисфункцией NMDA-рецепторов. |
 |
Рис. 4. Взаимодействие глутамата и ионных каналов |
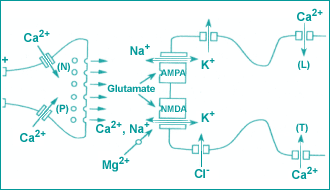 |
В ишемическом каскаде при патологии мозга большую роль играют глутаматные рецепторы. В настоящее время выделяют пять типов глутаматных рецепторов (рис. 3). Наиболее изученными и имеющими значение для патологии являются NMDA-аспартатовые рецепторы. Ишемический каскад связан с NMDA-рецепторами. Глутаматные рецепторы имеют большую связь с ионными каналами (рис. 4). Поэтому вместе образуется функциональное звено глутаматно-ионный комплекс. Глутамат активирует рецепторы, происходит вхождение внутрь клетки кальция и выход калия. Это наиболее значимые ионные нарушения, которые возникают при возбуждении глутаматных комплексов.
В настоящее время хорошо изучен химический каскад, который развивается при любой степени ишемии в большей или меньшей степени (рис. 5). С ишемией связаны нарушения поступления кислорода и глюкозы. В результате происходит деполяризация клеточных мембран, выброс, высвобождение глутамата, активация МДА-рецепторов, активация кальциевых каналов. Далее происходит увеличение внутриклеточного калия, активация ферментов, синтез окиси азота и образование свободных радикалов, В результате этих звеньев и при выраженных нарушениях возникает необратимая клеточная смерть или апоплексическая деполяризация нейронов.
 |
Рис. 5. Схема ишемического каскада
|
| Ишемия |
| Снижение поступления кислорода и глюкозы |
| Деполяризация клеточных мембран |
| Высвобождение глутамата и активация NMDA- и AMPA-рецепторов |
Активация потенциал-зависимых кальциевых каналов |
| Увеличение внутриклеточного кальция |
|
 |
Протеолиз |
 |
Синтез окиси азота |
 |
Липолиз |
 |
|
| Образование свободных радикалов |
| Необратимая клеточная смерть |
|
Лечение должно быть направлено на разрыв звеньев этого ишемического каскада. Внутриклеточный ацидоз образуется при внутриклеточном накоплении ионов водорода и лактата. Ацидоз влияет на окислительное фосфорилирование митохондрий и способствует развитию внутриклеточного отека.
Внутриклеточная гиперкальциемия — очень важное звено в ишемическом каскаде. Концентрация ионов кальция способствует деполяризации мембран вследствие внутриклеточной гипонатриемии, которая приводит к повреждению нейронов. Происходит активация АТФ-киназы, повышение внутриклеточного АТФ, активация кальций-зависимых протеаз, фосфолипаз, нарушение фосфорилирова-ния белков. Это приводит к нарушению синтеза белков и экспрессии генов. Таким образом, внутриклеточная гиперкальциемия запускает механизм, приводящий к активации внутриклеточных ферментов, что в свою очередь приводит к нарушению синтеза белков.
Ишемический отек мозга возникает в результате повреждения клеточной мембраны и внутриклеточного накопления ионов натрия, хлора и ацидоза. Он начинается уже через несколько часов после начала ишемии головного мозга, после начала инсульта, достигает максимума на 2-4-й день и регрессирует в течение 7-14 дня.
Большое значение в патологии имеет развитие оксидантного стресса. Оксидантный стресс, также как ишемический каскад, в настоящее время хорошо изучен. Он заключается в избыточном внутриклеточном накоплении свободных радикалов, активации процессов перекисного окисления липидов и избыточного их накопления. Это возникает при возбуждении глутаматных рецепторов и усиливает глутаматный экзайтоксический эффект. Оксидантный стресс взаимодействует с ишемическим каскадом и они обладают эффектом взаимного усиления.
Свободные радикалы — это атомные молекулы с непарным электроном: активные формы кислорода, пероксид водорода, альдегиды. Процессы свободнорадикального окисления нужно рассматривать как необходимое метаболическое звено в окислительном фосфолирировании, биосинтезе простангландинов и нуклеиновых кислот, иммунных реакциях. Свободные радикалы образуются при перекисном окислении ненасыщенных жирных кислот с регуляцией физических свойств биологических мембран.
 |
Рис. 6. Корреляции функции метаболизма и мозгового кровотока
|
|
|
Метаболизм
Активация глутамат-
продуцируемого расщепления глюкозы до лактата в перивас-
кулярных астроцитах |
|

Кровоток
Активация глутамат-
продуцируемого оксида азота в нейронах и астроцитах с увеличением кровотока |
|
|
|
Оксид азота выполняет роль нейромедиатора и принимает участие в регуляции кровотока. На рис 6. представлена схема корреляции нейрональной активности мозгового метаболизма и кровотока в физиологических условиях. Как видно на рис. 6, повышение нейрональной активности сопровождается активацией глутаматных нейромедиаторных комплексов с последующей активацией глутуматпродуцируемых расщепления глюкозы и образования оксида азота, что приводит к увеличению метаболизма и кровотока и метаболическому обеспечению повышенной нейрональной активности. С другой стороны, свободнорадикальное окисление является универсальным патофизиологическим феноменом при многих патологических состояниях. Кислород для любой клетки, особенно для нейрона, является ведущим энергоакцептором в дыхательной митохондриальной цепи. Связываясь с атомом железа цитохромоксидазы, молекула кислорода подвергается четырехэлектронному восстановлению и превращается в воду. Но в условиях нарушения энергообразующих процессов при неполном восстановлении кислорода происходит образование высокореактивных, а потому токсичных, свободных радикалов или продуктов, их генерирующих.
Образование первичных СР (семихинонов) связано с нарушениями процессов окисления в дыхательной цепи, превращении ксантина, синтезе лейкотриенов и простогландинов. В данном процессе посредством реакций с ксантиноксидазой, дегидроротатдегидрогеназой, альдегидоксидазой, холестериноксидазой, ферментом цитохромом Р-450 участвуют такие переносчики электронов, как: коэнзим Q и флавопротеины, супероксид и монооксид азота (.NO), выполняющие полезные для организма функции (например, вазодилатирующий эффект).
Из первичного СР-супероксида, а также в результате других реакций, в организме образуются такие активные вещества, как: перекись водорода, гипохлорит и гидроперекиси липидов. Данные соединения получили название “реактивные молекулы”.
Перекись водорода, гидроперекиси липидов, пероксинитрит, гипохлорит, образуют СР в присутствии ионов металлов переменной валентности (например, ионов двухвалентного железа) с использованием водорода НАДФ-Н, НАД-Н — его донаторов. Такие СР, как радикал гидроксила и радикалы липидов, в отличие от первичных, образуются в неферментативных реакциях и их физиологически полезные функций не установлены. Напротив, они обладают разрушительным действием на структуры клетки.
Относительная доступность и легкость образования свободных радикалов в условиях неполного восстановления кислорода связана с уникальными свойствами его молекул. В химических соединениях атомы кислорода двухвалентны. Основной устойчивой формой кислорода является так называемый “триплетный” кислород, в молекуле которого оба непарных электрона параллельны, но их спины (валентности) направлены в одну сторону. При разнонаправленном расположении спинов в молекуле образуется синглетный кислород, который по своим химическим свойствам является нестабильным и токсичным для биологических субстанций.
Патологическое действие СР связано прежде всего с их влиянием на структурное состояние и функции биологических мембран. Установлено, что гипоксия и ишемия тканей сопровождается активацией перекисного окисления липидов. Как известно, в состав клеточных мембран входит большое количество фосфолипидов. При появлении в мембране свободного радикала вероятность его взаимодействия с жирной кислотой нарастает по мере увеличения числа кратных связей. Поскольку ненасыщенные жирные кислоты обеспечивают мембранам большую подвижность, то их изменения в результате процессов перекисного окисления липидов приводит как к увеличению вязкости мембран, так и к частичной утрате барьерных функций.
В настоящее время не вызывает сомнения факт изменения под действием свободных радикалов функциональных свойств ряда ферментов, углеводов и белков, в том числе белков ДНК и РНК.
Наряду с свободнорадикальным окислением в процессе функционирования биологических объектов вырабатываются вещества из групп радикалов, обладающие антиоксидантным действием, которые называют стабильными радикалами. Такие радикалы не способны отрывать атомы водорода от большинства молекул, входящих в состав клетки, но могут совершать эту операцию с особыми молекулами, имеющими слабо связанные атомы водорода. Последний класс химических соединений получил название антиоксидантов (АО), поскольку механизм их действия основан на торможении свободнорадикальных процессов в тканях. В отличие от нестабильных свободных радикалов, оказывающих повреждающее действие на клетки, стабильные свободные радикалы тормозят развитие деструктивных процессов.
Существующая в организме физиологическая антиоксидантная система представляет собой совокупную иерархию защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание в пределах нормы реакций организма, в том числе, в условиях ишемии и стресса. Сохранение окислительно-антиоксидантного равновесия, являющегося важнейшим механизмом гомеостаза живых систем, реализуется как в жидкостных средах организма (кровь, лимфа, межклеточная и внутриклеточная жидкость), так и в структурных элементах клетки, прежде всего в мембранных структурах (плазматических, эндоплазматических и митохондриальных, клеточных мембранах). К антиокислительным внутриклеточным ферментам относятся супероксиддисмутаза, осуществляющая инактивацию супероксидного радикала и каталаза, разлагающая пероксид водорода.
При длительной ишемии мозга происходит истощение антиоксидантных систем и накопление продуктов перекисного оскисления липидов.
 |
Рис. 7. Основные медиаторы смерти нейрона
|
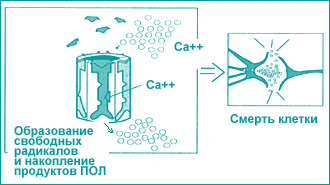 |
Таким образом, основными причинами клеточного повреждения мозга являются, так называемые медиаторы смерти нейронов. Это образование свободных радикалов и накопление продуктов перекисного окисления липидов и внутриклеточная гиперкальциемия (рис. 7).
Имеется несколько уровней, с которыми связано повреждающее действие ишемии. Зона ишемии представляет собой образование ядерной зоны. Ядерная зона — это фактически зона, которая содержит в себе необратимые повреждения нейронов, с необратимым механизмом восстановления. В этих нейронах происходит апоплексическая деполяризация клеточных мембран как правило, кровоток в этих ядерных зонах снижается до 10 и ниже мл на 100 грамм ткани мозга в минуту. Эта ядерная зона, которая не восстанавливается, происходит необратимое нарушение функции. Эту зону окружает зона ишемических “полутеней”.
Это нейроны, которые имеют функциональные нарушения, пока еще не структурные. При благоприятных условиях, восстановлении кровотока и метаболизма нейроны в этой зоне могут восстанавливать свои функции.
Почему возникают ишемические “полутени”? Существует два уровня кровотока. Один критический уровень кровотока характерен для биоэлектрической активности клетки, он составляет 20мл/100 грамм ткани мозга/мин. Второй критический уровень относится к ионным клеточным насосам и поддержанию клеточного гомеостаза и равняется 15мл/100 грамм мозга/мин. Клетки с объемным кровотоком, находящиеся между двумя этими уровнями, образуют ишемические полутени. Функция клеток временно приостановлена, нарушена, но структурных необратимых повреждений еще нет. При лечении ишемии мозга происходит борьба за восстановление функции этой зоны ишемических “полутеней”.
Зона кровотока ишемических “полутеней” имеет мозаичный характер без плотного зонального различия. Это связано с особенностями микроциркуляции, местной редукции кровотока, реологических свойств крови. На первое место выступают нарушения микрогемоциркуляции, закупорка микротромбами, артерий, капилляров и других микрососудов, что объясняет особенности мозаичного характера ишемических полутеней.
Когда кровоток восстанавливается, возникает вопрос: хорошо это или плохо? Казалось бы, что в этом плохого? Была временная окклюзия кровотока, потом все восстановилось. Но вслед за восстановлением кровотока, особенно если окклюзия была весьма длительной — больше нескольких минут, а если и часов, то возникает каскад патологических феноменов, связанный с реперфузией. Кровоток поступает в зону ишемизированной артерии, с повышенной проницаемостью сосудистой стенки. Это вызывает свой комплекс патогенетических механизмов, который также необходимо учитывать.
При этом возникает поэтапное изменение артериальной перфузии мозга. Сначала возникает постишемическая гиперперфузия с высвобождением вазоактивных и противовоспалительных метаболитов. При этом потребность мозга не соответствует кровотоку, кислород и глюкоза не усваиваются мозговой тканью. Следующий этап — это постишемическая гипоперфузия — ограничительный кровоток. Если происходит нарушение микрогемоциркуляции, то возникает зона невосстановленного кровотока. Невосстановленный кровоток объясняется нарушением микроциркуляции, снижением просвета сосудов и отеком мозга. Постишемическая гипоперфузия, наступающая вслед за гиперперфузией, также неблагоприятна, как и гиперперфузия. Поэтому синдром реперфузии имеет свою патологическую значимость. Это нужно учитывать при проведении лечения.
Очень большое значение в диагностике имеет компьютерная рентгеновская томография. Она предпочтительна перед магнитной резонансной томографией, поскольку в первые сутки инсульта она наиболее достоверна. На рис. 8 представлены рентгеновские компьютерные томограммы в различных сроки инфаркта мозга. Видно, что в первые часы зона структурных изменений и инфаркта мозга не сформировалась. Это подтверждает концепцию “терапевтического окна”, в соответствии с которой наиболее эффективное лечение возможно при его начале в первые 6 часов.
При востановлении функций после перенесенного инфаркта мозга репаративные процессы имеют определенную законромерность (рис. 9). Рядом с ядерной зоной необратимого поражения мозга формируются зоны пластичности и вторичной замены утраченных функций, при этом аналогичные зоны гиперметаболизма формируются в симметричных областях противоположного полушария мозга (рис. 10).
 |
Рис. 11. Современные принципы лечения острой ишемии мозга
|
|
Организация лечения:
Ранняя госпитализация (в первые 3-6 час.)
Лечение в палате интенсивной терапии или реанимационном специализированном отделении
КТ-диагностика при госпитализации
Мониторирование с компьютерной ЭЭГ
Ультразвуковая экстра- и интракраниальная допплерография
|
|
В заключение — то, что касается современных принципов лечения острой ишемии головного мозга. Прежде всего — вопросы, касающиеся организации лечения (рис. 11). Это очень важный вопрос потому, что время на восстановление функций зоны ишемических “полутеней” — 6-8 часов, а лучше — 3 часа. Следовательно, больной должен поступить в лечебное учреждение в первые 3-6 часов от начала инсульта. Лечение должно проходить в специализированном отделении, блоке интенсивной терапии или специализированном реанимационном отделении, т.к. больному требуется активная инфузионная терапия. В первые часы после инсульта обязательно должна быть проведена рентгеновская компьютерная томография. Назначение лекарственных препаратов желательно осуществлять с мониторированием функций мозга с помощью компьютерной электроэнцефалографии и ультразвуковой допплерографии.
 |
Рис. 12. Современные принципы лечения острой ишемии мозга
|
|
Базисная терапия:
Коррекция нарушений дыхания
Стабилизация гемодинамики
Коррекция кислотно-щелочного, водно-электролитного и осмолярного гомеостаза
Лечение внутричерпной гипертензии
Профилактика осложнений
|
|
На рис. 12 приведены принципы базисной терапии. Они хорошо известны и касаются общих принципов ведения больного инсультом. Это коррекция нарушений дыхания, стабилизация гемодинамики. Очень важно не допускать ишемию мозга, индуцированную лекарственными препаратами. Нельзя больного с инфарктом мозга активно лечить гипотензивными препаратами. Нельзя допускать артериальную гипотензию — 110-120 мм рт. ст., поскольку при этом усиливается редукция мозгового кровотока. Обязательно проводится коррекция различных видов гомеостаза: щелочного, водно-электролитного, т.к. существует опасность избыточной гидратации мозга при назначении дегидратирующих препаратов. При избыточной гидратации мозга возникает гемоконцентрация и ухудшение реологических свойств крови, агрегации тромбоцитов, эритроцитов, закупорка мелких артерий. Поэтому излишняя гипергидратация также вредна, как и повышение давления. Необходимо проводить профилактику осложнений, в первую очередь пневмоний, тромбоза.
 |
Рис. 13. Современные принципы лечения острой ишемии мозга
|
|
Патогенетическое лечение должно быть обосновано в зависимости от:
подтипа инфаркта мозга
времени его возникновения
стадии процесса
выявленных механизмов патогенеза
наличия сопутствующих заболеваний и соматических осложнений
|
|
На рис. 13 приведено патогенетическое обоснование фармакотерапии инфаркта мозга. Современные принципы лечения включают терапевтическую реперфузию. Это пока еще наименее изученный раздел, касающийся острой ишемии мозга, поскольку работы сейчас проводятся — крупные международные исследования. Они касаются рекомбинантов — применения тканевого активатора плазминогена, с его помощью достигается лизис тромба в артерии мозга и восстанавливается кровоток. Но поскольку имеется много неблагоприятных факторов, связанных с реперфузией, то их назначение вызывает дискуссию.
Прямые антикоагулянты более часто назначаются при постановке диагноза и раннем поступлении больного — первые 6 часов. Преимущественно речь идет о фраксипарине. К косвенным методам улучшения мозгового кровотока относятся гемодилюция и антиагрегантная терапия, улучшающая реологические свойства крови, что очень важно для восстановления кровотока.
Нейропротективная терапия направлена на снижение глутаматной экзайтоскичности, внутриклеточной гиперкальциемии и снижение синтеза оксида азота. В ближайшее время мы надеемся получить препараты, влияющие на экзайтоксикоз и глутаматный выброс. Пока таких препаратов нет. Назначается нимодипин — блокатор кальциевых каналов. К антагонистам глутаматных рецепторов относится сернокислая магнезия. Изучается влияние хорошо известных производных пиролидона (ноотропил) на ингибирование синтеза и высвобождения глутамата.
Перспективно применение многокомпонентных препаратов с нейропротективным, ноотропным и антиоксидантным эффектом растительного происхождения. К таким препаратам относятся Болюсы Хуато.
Большое значение имеет антиоксидантная терапия. В последние годы изучается действие янтарной кислоты, ее солей и эфиров, представляющих собой универсальные внутриклеточные метаболиты. Янтарная кислота, содержащаяся в органах и тканях, является продуктом пятой реакции и субстратом шестой реакции цикла трикарбоновых кислот. Антигипоксическое действие янтарной кислоты обусловлено ее влиянием на транспорт медиаторных аминокислот, а также за счет увеличения содержания в мозге гамма-аминомасляной кислоты пои функционировании шунта Робертса. Янтарная кислота в организме в целом нормализует содержание гистамина и серотонина и повышает микроциркуляцию в органах и тканях, прежде всего в тканях мозга, не оказывая влияния на артериальное давление и показатели работы сердца. Противоишемический эффект янтарной кислоты связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной митохондриальной цепи — цитохромоксидазы.
В настоящее время продолжается изучение использования производных янтарной кислоты с целью уменьшения выраженности ишемических повреждений головного мозга. Одним из таких препаратов является отечественный препарат “мексидол”. Мексидол является антиоксидантом — ингибитором свободных радикалов, мембранопротектором, уменьшает активацию перикисного окисления липидов, повышает активность физиологической антиоксидантной системы в целом. Мексидол является также антигипоксантом прямого энергизирующего действия, активируя энергосинтезирующие функции митохондрий и улучшая энергетический обмен в клетке. Препарат обладает гиполипидемическим действием, уменьшая уровень общего холестерина и липопротеидов низкой плотности.
Мексидол оказывает модулирующее влияние на мембраносвязанные ферменты, ионные каналы — транспортеры нейромедиаторов, рецепторные комплексы, в том числе бензодиазепиновые, ГАМК и ацетилхолиновые, улучшает синаптическую передачу и, следовательно, взаимосвязь структур мозга. Кроме этого мексидол улучшает и стабилизирует мозговой метаболизм и кровоснабжение головного мозга, корригирует расстройства в регуляторной и микроциркуляторной системах, улучшает реологические свойства крови, подавляет агрегацию тромбоциов, улучшает деятельность иммунной системы.
Высокая активность янтарной кислоты нашла применение в дезинтоксикационном растворе “Реамберин 1,5% для инфузий”, в состав которого входят соль янтарной кислоты и микроэлементы в оптимальных концентрациях (магния хлорид, калия хлорида и натрия хлорид). Препарат обладает выраженным антигипоксическим и антиоксидантным действием, оказывая положительный эффект на аэробные биохимические процессы в клетке в период ишемии и гипоксии, уменьшая продукцию свободных радикалов и восстанавливая энергетический потенциал клетки. Препарат инактивирует ферментативные процессы цикла Кребса и способствует утилизации жирных кислот и глюкозы клетками, нормализует кислотно-щелочной баланс и газовый состав крови. Препарат может быть использован в качестве энергокорректора у больных с первичными и вторичными ишемическими поражениями мозга, в том числе на фоне развития синдрома полиорганной недостаточности, при этом отмечено уменьшение выраженности эндотоксикоза и постишемических поражений как по клинико-лабораторным, так и по энцефалографическим показателям.
В последние годы активно изучается природный антиоксидант — тиоктовая (ли-поевая) кислота. Тиоктовая кислота необходима для регенерации и восстановления витамина Е, цикла витамина С и генерации Q-энзима (убихинона), являющихся самыми важными звеньями антиоксидантной защиты организма. Кроме того, тиокотовая кислота может взаимодействовать с другими соединениями, восстанавливая пул антиоксидантов в организме. Тиоктовая кислота облегчает превращение молочной кислоты в пировиноградную с последующим ее декарбоксилированием, что способствует ликвидации метаболического ацидоза. Отмечено положительное липотропное действие тиоктовой кислоты. Уникальность химической структуры тиоктовой кислоты позволяет осуществлять ее регенерацию самостоятельно, без участия других соединений.
Тиоктовая кислота в настоящее время применяется в виде ее трометамоловой соли (препарат “Тиоктацид”). При критических неврологических состояниях лечение тиоктацидом следует начинать с внутривенных инфузий по 1 ампуле (600 мг тиоктовой кислоты) в разведении 200 мл физиологического раствора в сутки в течение 2-3 недель. Далее назначаются таблетки тиоктацида по 600 мг 1 раз утром, за 30 мин до завтрака. В выраженных случаях заболевания возможно применение суточной дозировки 1800 мг тиоктацида на 3 приема. Курс лечение 1-2 месяца.
Альфа-токоферол, аскорбиновую кислоту и метионин целесообразно включать в комплекс восстановительного лечения многих неврологических заболеваний и их последствий. Их недостатком является слабо выраженная антиоксидантная фармакокинетика и необходимость для развития антиоксидантного эффекта длительного (в течение нескольких недель) применения этих препаратов.

Использование Болюсов Хуато при дисциркуляторной энцефалопатии
И.В. Дамулин, В.В. Захаров, Н.Н. Яхно
кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова

Дисциркуляторная энцефалопатия (ДЭ) — это синдром очагового или диффузного поражения головного мозга, проявляющийся целым рядом нарушений: клинических неврологических, нейропсихологических, в ряде ситуаций — психических, и связан с хронической сосудистой мозговой недостаточностью и/или острыми нарушениями мозгового кровообращения. Возникновение острых эпизодов церебральной дисгемии может усугубить течение ДЭ.
Термин “дисциркуляторная энцефалопатия” отражает как патогенетические, так и морфологические особенности поражения головного мозга, обусловленные цереброваскулярным заболеванием. Патогенетические механизмы, которые могут приводить к возникновению ДЭ, весьма многообразны. Это хроническая сосудистая мозговая недостаточность, острые цереброваскулярные нарушения, а также т.н. “незавершенные инсульты”. Под “незавершенным инсультом” понимается область, окружающая зону инфаркта, по своим характеристикам (морфологическим, патогенетическим) отличная от некроза. Как раз с зоной незавершенного инсульта нередко связывают надежды на эффективность терапии, как острых, так и хронических цереброваскулярных нарушений.
Вторая часть термина ДЭ — “энцефалопатия” отражает ряд изменений, которые раньше определялись, в основном, на аутопсии. В настоящее время с внедрением в практику методов нейровизуализации эти изменения можно оценивать прижизненно. Это постишемические кисты различной локализации, диффузные изменения белого вещества (лейкоареоз), а также церебральная атрофия. Лейкоареоз нередко визуализируется у пациентов с ДЭ при помощи компьютерной томографии, а еще лучше — магнитно-резонансной томографии. Церебральная атрофия проявляется расширением желудочковой системы и субарахноидальных пространств. Следует заметить, что атрофические изменения головного мозга и лейкоареоз могут отмечаться и при нормальном старении, а также при дегенеративных процессах, приводящих к когнитивным нарушениям, например, при болезни Альцгеймера.
Патогенез клинических проявлений ДЭ определяется двумя основными факторами. Первый — это очаговое повреждение тех или иных корковых и субкортикальных зон, что сопровождается возникновением в клинической картине ряда довольно хорошо изученных синдромов. Вторым фактором является т.н. феномен корково-подкоркового разобщения, который обусловлен нарушением связей как корковых зон друг с другом, так и коры мозга с субкортикальными структурами. Существует целый ряд клинических синдромов, которые могут возникать у пациентов с этим феноменом. Среди них следует упомянуть псевдобульбарные и постуральные расстройства, а также нарушения когнитивных функций. Важную роль в возникновении феномена разобщения играет нарушение связей передних (фронтальных) отделов головного мозга.
Основные клинические признаки ДЭ столь же многообразны, сколь многообразны и варианты поражения головного мозга сосудистого генеза. Но все же, среди них можно выделить два основных вида нарушений, нередко лежащих в основе инвалидизации пациентов. Это двигательные и когнитивные расстройства.
Двигательные расстройства полиморфны по своей феноменологии. В частности, это могут быть пирамидные расстройства, и не обязательно — с наличием пареза; а также экстрапирамидные нарушения, чаще в виде гипокинезии в нижних конечностях (дрожание для данной категории больных не характерно). Также у больных с ДЭ могут выявляться атактические расстройства сложного генеза и псевдобульбарный синдром.
Второй блок проблем связан с нарушениями высших мозговых функций. В тяжелых случаях это довольно очерченные синдромы, например, афазия, агнозия, апраксия, нарушения контроля и регуляции психической деятельности. В более легких случаях могут выявляться лишь нарушения, обусловленные замедлением скорости психических процессов, снижение внимания и памяти.
Одним из наиболее клинически ярких проявлений ДЭ является сосудистая деменция. Во всем мире, как считается, около 25-30 млн. больных, страдающих различными вариантами деменции. Причем, в Северной Америке и Западной Европе превалирует болезнь Альцгеймера; в России, Финляндии, Китае и Японии сосудистая деменция встречается чаще болезни Альцгеймера. Достоверных объяснений этому в настоящее время нет. Возможно, причиной является недостаточный контроль артериальной гипертензии.
Среди факторов, приводящих к возникновению сосудистой деменции, артериальная гипертензия играет важнейшую роль. Кроме того, возникновение сосудистой деменции может быть обусловлено атеросклеротическим поражением экстракраниальных и интракраниальных сосудов. Еще одним фактором риска является сахарный диабет. Наличие сахарного диабета сопровождается микро- и макроангиопатией, что и приводит к поражению головного мозга. Определенное значение придается гиперлипидемии, курению и наследственному фактору. Наследственные нарушения, лежащие в основе сосудистой деменции, в настоящее время активно изучаются. В частности, для синдрома ЦАДАСИЛ характерно наличие повторных нарушений мозгового кровообращения, приводящих к возникновению лейкоэнцефалопатии, нередко у пациентов имеется мигрень, а в последующем возникает деменция.
Следует подчеркнуть, что в головном мозге существуют определенные, анатомически достаточно очерченные, зоны, поражение которых весьма важно как для возникновения сосудистой деменции, так и для ее прогрессирования. Это глубинные отделы височных долей, гиппокамп — структура, которой придается особое значение в осуществлении мнестических процессов, лобные доли и их связи, мозолистое тело. Существуют и определенные анатомические предпосылки, предрасполагающие к поражению данных зон при цереброваскулярной патологии. В частности, артерии, кровоснабжающие глубинные отделы полушарий головногс мозга, отходят под прямым углом. Поэтому при артериальной гипертензии именно эти участки часто подвергаются изменениям. Здесь же могут возникнуть разрывы сосудов с клиникой ограниченных гематом.
Диагностика ДЭ основывается на результатах клинического исследования и на параклинических данных. Следует подчеркнуть то, что клинические данные являются приоритетными. Дополнительные методы лишь помогают диагностике, однако они порой дают такую информацию, которую с помощью клинических методов бывает сложно и предположить.
Среди параклинических методов исследования следует особо упомянуть методики исследования сердечно-сосудистой системы и методы нейровизуализации. Используются биохимическое исследование крови и исследование системы гемостаза, кардиологическое обследование включает электрокардиографию, эхокардиографию, методики ультразвуковой допплерографии, при наличии показаний используется ангиография. В настоящее время появились методы функциональной нейровизуализации, которые помогают оценить регионарный мозговой кровоток и метаболизм. Все перечисленные методы, разумеется, одному пациенту не назначаются. Порой в этом нет смысла. Оценивается конкретная ситуация. Например, если у пациента предполагается наличие аритмии, то проводится холтеровское мониторирование.
Переходя к рассмотрению терапевтических аспектов ДЭ, следует подчеркнуть то, что идеальным является воздействие на этиологический фактор. Однако на практике это не всегда возможно. Вторичная профилактика сосудистой мозговой недостаточности включает использование лекарственных средств и хирургическое лечение (операции на магистральных сосудах головы при наличии соответствующих показаний). Это приводит к улучшению церебрального кровотока и метаболизма. Кроме того, проводится симптоматическая терапия и общетерапевтические меры.
Важное значение придается препаратам ноотропного действия. Среди препаратов, используемых в качестве ноотропов, выделяют, т.н. “истинные ноотропы” (препараты, обладающие только ноотропным действием) и препараты “смешанного действия”, оказывающие влияние, как на церебральный метаболизм, так и церебральный кровоток.
Существующие на сегодняшний день экспериментальные данные свидетельствуют о способности растительных препаратов, в частности приготовленных на основе корня женьшеня, улучшать память, способность к обучению, увеличивать число нейронов в области гиппокампа, усиливать действие фактора роста нервов. Это лежит в основе увеличения репаративных свойств структур головного мозга, при этом открываются возможности компенсации церебральных функций. Меняется соотношение ацетилхолинтрансферразы к ацетилхолинэстеразе. Это свидетельствует о том, что тот уровень ацетилхолина, который уменьшается как при нормальном состоянии, так и при болезни Альцгеймера, удается либо стабилизировать, либо несколько увеличить. Кроме того, увеличивается количество М-холинергических рецепторов в коре. В случае экспериментальной модели церебральной ишемии, что достигается перевязкой обеих сонных артерий, назначение определенных препаратов растительного происхождения сопровождается уменьшением летальности экспериментальных животных. Кроме того, эти препараты уменьшают агрегацию тромбоцитов и образование свободных радикалов. По имеющимся данным, в 1997 году в США продажи препаратов на основе корня женьшеня превысили 300 млн. долларов.
Поэтому интерес к Болюсам Хуато вполне объясним. Есть объективное противопоставление медицины Западной медицине Восточной. Болюсы как раз и есть тот шаг навстречу друг другу Западной и Восточной медицины.
Исследование, которое проводилось в нашей клинике, ставило целью оценить влияние Болюсов Хуато на когнитивные функции у пациентов с ДЭ и в восстановительном периоде ишемического инсульта. Проводилась оценка нейропсихологических функций при помощи специальных тестов. Кроме того, оценивались двигательные нарушения при помощи стандартной формализованной шкалы Тинетти. Эта шкала широко используется в практике, особенно при оценке состояния пожилых больных, и представляет собой ряд тестов, помогающих оценить отдельно стояние, равновесие в покое и ходьбу. Кроме того, оценивалось влияние лечения на субъективные симптомы и гемодинамические показатели. У больных, перенесших инсульт, использовались соответствующие шкалы — скандинавская шкала и шкала Оргогозо. Нейропсихологическое исследование проводилось при помощи стандартных методик, оценивающих внимание, память, беглость речи и психомоторные функции. Болюсы назначали 2 раза в день утром и днем за 1 час до еды в течение 2-х месяцев. Через каждые 10 дней делался перерыв на 1 день. Исследование было открытым и несравнительным.
В исследование было включено 20 пациентов с ДЭ II-III ст. в возрасте от 49 до 79 лет (средний возраст — 63 года). Также в исследование было включено 10 пациентов в восстановительном периоде ишемического инсульта, примерно аналогичного возраста.
Артериальная гипертензия и патология магистральных артерий головы встречались приблизительно одинаково у той и у другой выборки больных. Статистически значимых различий по этим факторам среди обеих групп не было. У подавляющего числа больных имелось несколько сосудистых факторов риска.
Наиболее часто пациенты предъявляли жалобы на головную боль, которая отмечалась практически у всех больных, и головокружение. У 75% больных имелись когнитивные нарушения, у 60% — атаксия, а также негрубые пирамидные нарушения — у 40%, псевдобульбарные расстройства — у 35%.
Серьезных побочных реакций на фоне проводимой терапии не наблюдалось. Все пациенты полностью прошли курс лечения. Общая оценка исследователем как в группе пациентов с ДЭ, так и в восстановительном периоде ишемического инсульта соответствовала умеренному или выраженному эффекту. Субъективно у пациентов уменьшилась выраженность и частота встречаемости головной боли, головокружения, шума в ушах, уменьшилась утомляемость. Больные реже стали предъявлять жалобы на снижение памяти.
По данным объективного тестирования у пациентов с ДЭ после курса терапии увеличилась устойчивость в покое, улучшилась ходьба, а общий балл по шкале Тинетти стал выше. Аналогичные изменения отмечены и у пациентов, перенесших инсульт. Кроме того, у пациентов, перенесших инсульт, улучшилось показатели Скандинавской шкалы и шкалы Оргогозо.
Проведенное исследование выявило улучшение психомоторных и мнестических (тест “тройки”, проба с 10 словами) функций. Кроме того, некоторые больные отметили улучшение настроения, снижение тревожности, уменьшение эмоциональной лабильности.
Нежелательные побочные явления были отмечены в 13% случаев. Ни в одном случае мы не отменяли полностью препарат. В основном использовались либо уменьшение дозировки, либо временный пропуск приема препарата. В единичных случаях была отмечена повышенная раздражительность, а также эпизоды повышения давления. После уменьшения дозы эти явления прошли.
Таким образом, проведенное исследование показало, что Болюсы Хуато обладают положительным эффектом при ДЭ и в восстановительном периоде ишемического инсульта. У больных после курса терапии улучшаются двигательные и когнитивные функции. Также мы отметили у пациентов уменьшение тревожности и эмоциональной лабильности, что свидетельствует о возможном антидепрессивном эффекте препарата. Для уточнения механизмов действия препарата необходимы дальнейшие исследования.

Нейропротективная терапии ишемии мозга
С.А. Румянцева
доцент кафедры неврологии и нейрохирургии ФУВ РГМУ

Цереброваскулярные заболевания за последние годы становятся основной социально-медицинской проблемой клинической неврологии. Достаточно часто врачи-неврологи поликлинической сети и стационаров встречаются с пациентами, перенесшими те или иные формы острых нарушений мозгового кровообращения. Обычно поликлиническая медицинская помощь оказывается пациенту с уже состоявшимся инсультом на основании стандартной выписки из стационара. Когда речь идет о пациентах с так называемой хронической ишемией головного мозга до инсультного периода, то им, в большинстве случаев, медицинская помощь оказывается в условиях поликлиники и далеко не всегда она бывает высокоэффективной и предотвращает ухудшение тяжести состояния больных или развитие нарушений мозгового кровообращения.
Какие же имеются сложности и проблемы в терапии хронической ишемии? Это прежде всего многокомпонентность ее этиопатогенеза (атеросклероз, гипертоническая болезнь, системные заболевания, влияющие как на состояние эндотелия артерий различного калибра с изменением проницаемости сосудистой стенки и их диаметра, так на физико-химические и реологические свойства крови, что в результате оборачивается резким снижением церебральной перфузии и возникновением локальной или диффузной ишемии). Именно многокомпонентность патогенеза делает достаточно сложной эффективное воздействие в условиях ишемии головного мозга. Кроме того, хроническая ишемия мозга практически в большинстве случаев является процессом динамическим и прогрессирующим. Выраженные сосудистые макро- и особенно микроциркуляторные изменения создают неблагоприятные условия для стабилизации функционирования мозга, приводит к частым срывам церебральной ауторегуляции, повторным ухудшениям церебрального кровотока, что становится морфологической основой нарастания клинических проявлений хронической ишемии мозга.
Чрезвычайно актуальна проблема индивидуализации терапии больных с хронической ишемией мозга при значительном потоке пациентов, особенно в условиях поликлинического приема, где в течении часа невролог должен по существующим нормам обслужить 6 больных.
Большое значение имеет также мультисистемность поражения. При явлениях хронической ишемии голоного мозга у пациентов достаточно часто возникает многоорганное поражение соматической сферы, связанное как с наличием фоновых и сопутствующих заболеваний, так с утратой пораженным мозгом регуляторно-трофических влияний на соматическую сферу, что ведет к снижению системной гемодинамики и формированию явлений хронического эндотоксикоза и значительно затрудняет проведение нейропротективной терапии.
И, наконец, к ухудшению результатов лечения хронической ишемии мозга ведет недостаточная эффективность современных средств нейрофармакологической коррекции.
Адекватность максимально ранней и эффективной комплексной терапии хронической ишемии мозга и острого церебрального инсульта, наряду с выраженностью первичных сосудистых и вторичных нейроморфологических расстройств, состоянием коллатерального кровоснабжения, определяет собой тяжесть течения и выраженность клинических проявлений этих заболеваний. Последовательное развитие и церебральных и мультиорганных расстройств у пациентов с хронической ишемией мозга включает утрату мозгом регуляторных влияний, ведущее к расстройствам системного гомеостатического равновесия, вторичным постишемическим аутоиммунным расстройствам и нарушениям в системах церебральной и органной макро- и микроциркуляции и перфузии. Дестабилизация соматической сферы на фоне первичных церебральных расстройств уже вторично усугубляет нейророморфологические нарушения и клинические проявления хронической церебральной ишемии.
Данные современных методов нейромониторинга и нейровизуализации (УЗДГ, УЗДС, КТ, МРТ, ЭЭГ, КСА ЭЭГ и картирование ЭЭГ) позволяют выявить локальные и диффузные структурные и функциональные изменения. Возникающие в веществе головного мозга на фоне острой и хронической ишемии, в том числе сосудистые очаги, лакунарные инфаркты, микрокисты, явления лейкариоза, клинически проявляющиеся в корково-подкорковом разобщении и расстройствах интегративной деятельности мозга. Именно особенности функционального состояния головного мозга в условиях острой и хронической ишемии, определяющие уровень реагирования церебральных структур как на ишемию и гипоксию, так и на нейропротекцию, должны лежать в основе эффективной терапии, В большинстве случаев ишемического и гипоксического поражения головного мозга имеет место снижение функциональной активности церебральных структур, т.н. церебральный гипометаболизм, но у почти 25% больных имеет место электроэнцефалографическая картина церебрального гиперметаболизма, даже в условиях тяжелого поражения мозга. Именно исходя из особенностей функционального состояния головного мозга должны использоваться те или иные виды нейропротективной терапии.
На какие же звенья патогенеза при развитии явлений церебральной ишемии должно быть оказано фармакологическое воздействие для поддержания эффективного функционального состояния мозга, определяемого снижением уровня нейроморфологических расстройств, т.е. снижением выраженности клеточного постишемического апоптоза?
В конечном итоге поддержание адекватного функционирования головного мозга является основой сохранения человека и как биологической субстанции и, прежде всего, как социального индивидуума. При этом постоянно необходимо помнить, что мозг не является изолированным от организма органом и эффективное влияние на церебральные структуры возможно только при системном комплексном воздействии на организменном, системном и клеточным уровне.
Терапевтическая стратегия эффективной нейропротекции на первом этапе должна заключаться прежде всего в активации перфузионных механизмов при явлениях острой и хронической ишемии, а также в снижении постреперфузионных и постишемических повреждающих воздействий. Этот этап первичной нейропротекции включает методы коррекции реологических свойств крови и поддержания эффективной системной гемодинамики и перфузионного церебрального давления с использованием реопротекторных препаратов и стабилизаторов системного артериального давления. Первичной нейропротекцией является также воздействие на глутаматные кальциевые каналы и оксидантную систему со снижением постишемического глутаматного выброса и уровня свободно-радикального окисления и оксидантного стресса, которые в комплексе обладают наиболее выраженным мембраноразрушающим действием.
Современные методы первичной и вторичной нейропротекции, означающей поддержание эффективного церебрального кровотока, метаболизма и такой их результирующей как интегративная деятельность головного мозга, включают использование антиоксидантов и антигипоксантов, нейротрофических факторов, ингибиторов цитокинов и других веществ, способствующих поддержанию морфологически-функциональной адекватности церебральных структур.
В современной неврологии широко используются стимуляторы нейрометаболизма, такие как ноотропил, глицин, аплегин, глиатилин; антиоксиданты — аскорбиновая кислота, витамин С, витамин Е, эмоксипин, олифен, мексидол, реамберин, цитофлавин и другие фенольные производные янтарной кислоты; антиоксиданты — цитохром С, актовегин, циррулоплазмин и некоторые другие; блокаторы кальциевых каналов, к которым относятся нимодипин, нимотоп, ингибиторы синтеза глутамата, препараты, в основе действия которых лежит снижение глутаматного выброса.
Современной науке пока известно всего два пути нормализующего воздействия на церебральный метаболизм, нарушенный в условиях ишемии и гипоксии, — это восстановление НАД-зависимого участка цикла Кребса или стимуляция альтернативного пути, которым является сукцинатоксидазное окисление или окисление янтарной кислоты, замещающее прерванные вследствие снижения содержания кислорода участки цикла окислительного фосфорилирования. Производные янтарной кислоты относятся к наиболее эффективным современным антиоксидантам.
В последние годы особое внимание неврологов привлекает нейрометаболит на основе комплекса лекарственных растений — Болюсы Хуато, зарегистрированный на отечественном фармакологическом рынке еще в прошлом веке (в 1999 году). Препарат уже нашел самое широкое применение для эффективного лечения пациентов с хронической ишемией головного мозга и пользуется заслуженной популярностью и среди неврологов и среди пациентов, ощутивших на себе его положительное действие.
Препарат содержит более 8 компонентов лекарственных растений, в том числе женьшень и другие, апробированные человечеством на протяжении многих столетий. Препарат не содержит ни одного химически синтезированного компонента, а только растительные вещества, широко используемые в том числе в китайской народной медицине, а также мед и энтеросорбенты в виде специально обработанного активированного угля. Эфферентные методы, в том числе энтеросорбция оказывает значительное положительное действие на церебральный метаболизм и кровоток, в том числе у больных с хронической ишемией, даже при изолированном ее применении, как было показано комплексными исследованиями нашей кафедры в течение последних 15 лет.
Преимуществами действия препарата Болюсы Хуато у больных с хронической ишемией является многокомпонентность воздействия этого комплексного растительного нейрометаболита, что обеспечивает влияние на многие звенья патогенеза при хронической ишемии головного мозга как на нейрональном, так на системном и организменном уровне за счет поддержания системной гемодинамики и активации механизмов ауторегуляции церебрального и органного кровотока, а также за счет снижения выраженности эндотоксикоза под действием длительной энтеросорбции. За счет отсутствия химических компонентов препарат является совершенно безопасным, что особенно актуально в условиях высокой аллергизации населения, когда требующие длительного лечения клинические симптомы хронической ишемии, могут быть скоррегированы высокоэффективным растительным нейрометаболитом.
На кафедре неврологии ФУВ РГМУ было проведено двойное слепое плацебо контролируемое исследование использования препарата Болюсы Хуато у 70 больных в восстановительном периоде церебрального инсульта. Критериями включения в исследование были: возраст до 70 лет, перенесенный инсульт давностью менее 1 года, подтвержденный данными КТ или МРТ, т.е. у всех больных имели место стойкие морфологические изменения в веществе головного мозга после перенесенной церебральной ишемии; отсутствие в анамнезе других предшествующих инсультов; отсутствие сахарного диабета.
Все больные были разделены на две возрастные группы до 55 лет и после 55 лет. 50 больных в каждой возрастной группе получали препарат Болюсы Хуато, 20 больных плацебо такого же вида, формы и запаха. Все пациенты получали по 24-48 болюса или препарата-плацебо в течение 3-х месяцев, у всех пациентов было получено информированное согласие на участие в исследовании. В период приема препарата другой нейрометаболической терапии пациенты не получали.
Было проведено комплексное клинико-инструментальное исследование с количественной оценкой показателей неврологического статуса по адаптированной шкале неврологического дефицита А.И. Федина с соавторами, включавшей бальную оценку практически всех параметров неврологического статуса, таких как состояние сознания, общемозговые, менингеальные симптомы, расстройства двигательной, чувствительной и координаторной, вегетативной сфер, высших корковых функций.
Проводилось также комплексное нейропсихологическое исследование по шкалам тревожности, шкале депрессии Бека, исследование памяти, липидного спектра крови, экстра и интракраниального кровотока методами ультразвуковой допплерографии и функционального состояния мозга методом ЭЭГ и компрессированного спектрального анализа ЭЭГ.
Расстройства липидного обмена во многом провоцируют первый инсульт и дальнейшее прогрессирование явлений хронической ишемии мозга в условиях нарастания выраженности системного и церебрального атеросклероза и расстройств реологических свойств крови.
Характеристика тяжести клинических проявлений хронической ишемии и последствий инсульта у больных всех групп была практически однотипной. На фоне двойного слепого плацебо контролируемого исследования при последующем анализе была выявлена значимо большая выраженность положительного влияния препарата Болюсы Хуато по сравнению с группой пациентов, получавших плацебо, на параметры неврологического статуса, и такие общемозговые симптомы как головная боль, головокружения, фотопсии, отмечалась стабилизация параметров вегетативного статуса, координаторной сферы.
По данным интракраниальной ультразвуковой допплерографии в группе плацебо динамика показателей отмечено не было. В группе пациентов, получавших Болюсы Хуато, было отмечено возрастание церебрального кровотока как экстра так и по интракранимальным сосудам в среднем на 30% от исходного уровня.
По данным КСА ЭЭГ у больных, получавших терапию Болюсами Хуато в отличие от пациентов из групп, получавших плацебо, было выявлено нарастание суммарной мощности спектра ЭЭГ, улучшение параметров частотного индекса, что свидетельствовало о стабилизации состояния функциональной активности головного мозга за счет уменьшения представленности медленно-волновой составляющей спектра.
Была отмечена положительная динамика по показателям личностной тревожности и шкале тревожности Бека, что является особенно актуальным именно для больных с симптомами хронической ишемии головного мозга, при которой отмечается значительное снижение личностной самооценки и нарастание тревожности, часты явления депрессии, снижение эмоционального фона настроения.
Улучшение этих показателей, как результата стабилизации состояния эмоциональной сферы, несомненно свидетельствовало об улучшении качества жизни пациентов с хронической ишемией на фоне терапии Болюсами Хуато.
При анализе состояния липидного спектра крови у больных на фоне терапии Болюсами Хуато было отмечено снижение уровня триглицеридов и холестерина, что является признаками стабилизации липидограммы.
Таким образом, проведенное исследование позволяет констатировать, что препарат Болюсы Хуато эффективен для лечения больных в восстановительном периоде ишемического инсульта и обладает многосторонним позитивным действием на сосудистую систему головного мозга, показатели системной гемодинамики, функциональное состояние мозга и липидного спектра крови, что позволяет рекомендовать данный препарат для эффективной терапии больных с клиническими симптомами хронической ишемии мозга.

Некоторые виды природного сырья, применяемые при создании средств лечения сосудистых заболеваний головного мозга
Б.Г. Валентинов, Э.М. Наумова, к.б.н., Г.Б. Селиванова, к.м.н.
Фонд содействия изучению и внедрению лекарственных средств растительного, животного и минерального происхождения, РГМУ 

Во многих случаях одним из основных преимуществ препаратов природного происхождения, применяемых в традиционной китайской медицине, является сбалансированное сочетание различных компонентов, обеспечивающих в совокупности достаточный терапевтический эффект и минимальный процент развития побочных реакций в отличие от монокомпонентных растительных лекарственных средств. В качестве примера предлагаем Вашему вниманию информацию по химическому составу и фармакологическому действию компонентов, входящих в состав препарата “Болюсы Хуато”.
В состав Болюсов Хуато входят: Софора японская, Женьшень, Дереза китайская, Офиопогон японский, Горечавка крупнолистная, Дудник даурский, Дудник китайский, Любисток сычуаньский, Коричник китайский, Эводия лекарственная, Мед и активированный уголь.

Цветы софоры японской
Сырье содержит тритерпеновые сапонины, флавоновые соединения: кверцетин, рутин, бетулин и софорадиол. Из цветочного масла выделяют лавровую, пальмитиновую, стеариновую, арахисовую и другие кислоты.
Рутин, кверцетин, увеличивают силу сокращений миокарда и сердечный выброс, замедляют частоту сердечных сокращений, кратковременно понижают артериальное давление, значительно сокращают время свертывания, время кровотечения, уменьшают отеки, вызванные экспериментальным тромбофлебитом, гидроцефалию, оказывают мочегонное действие, уменьшают уровень липидов крови.

Корень женьшеня
Корень Женьшеня содержит тритерпенозиды, эфирные масла, органические кислоты: цитрусовую, фумариновую, малеиновую, яблочную, янтарную, салициловую, ванильную, стеролы и гликозиды. В Женьшене также содержатся моносахариды, аминокислоты и полипептиды, Из свежих корней выделяют фосфатиды, более 26 видов неорганических элементов, такие как: алюминий, железо, кобальт, медь, молибден, марганец, никель, фосфор и другие, а также витамины 8а, В2, С, никотиновая кислота.
Женьшень оказывает многостороннее регулирующее действие на цнс: стимулирует кору головного мозга, усиливает процессы возбуждения и торможения, улучшает холинергическую передачу импульсов, стимулирует дыхательный центр. Сапонины Женьшеня повышают общий объем кровотока в мозге и объем кровотока в ишемизированных зонах, вызывают увеличение потребления глюкозы мозговой тканью.
Женьшень повышает адаптационные возможности организма, посредством влияния на нервную систему, железы внутренней секреции, иммунитет, метаболизм. Он также повышает устойчивость к воздействию физических, химических и биологических агентов.

Дереза китайская
Корни Дерезы содержат алкалоиды: бетаин, атропин, гиоциамин, полисахариды, аминокислоты: глютаминовую кислоту, пролин, глицин, аланин, метионин, лизин и другие. Из моносахаридов присутствуют: глюкоза, галактоза, арабиноза, рамноза, ксилоза. Дереза содержит витамины: Bl, В2, С, никотиновую кислоту и каротин, а также микроэлементы: кальций, фосфор, железо, натрий, магний, марганец, калий и другие.
При применении препаратов Дерезы наблюдали снижение холестерина в крови, торможение образования холестерина в печени. Метанол, метил-ацетил и другие растворы и экстракта Дерезы оказывают слабое гипотензивное действие.

Офиопогон японский
Корни содержат офиопогонин и другие агликоны (например, рускогенин), а также стеролы, натрий, калий, кальций, магний, железо, медь, кобальт, хром, марганец и другие микроэлементы.
Инъекционный раствор корней Офиопогона оказывает антиаритмическое действие, увеличивает коронарный кровоток, силу сокращений миокарда и замедляет ЧСС. В определенных пределах отрицательное действие инъекционного раствора Офиопогона японского на частоту сердечных сокращений нарастает с увеличением дозы. Раствор может эффективно блокировать бета1-адренорецепторы миокарда.
 Горечавка крупнолистная
Химический состав: алкалоиды (гентианин, гентианидин, гентианол); сахара; эфирные масла, циклоалкилэфиры терпеновых гликозидов.
В экспериментах выявили, что гентианин оказывает седативное действие, а также способен повышать порог болевой чувствительности, обладает гипотензивным эффектом, что сопровождается замедлением частоты сердечных сокращений. В экспериментах на животных показано, что внутривенное введение атропина и двухсторонняя ваготомия не влияют на гипотензивное действие гентианина. Эти данные свидетельствуют о том, что гипотензивное действие гентианина является результатом прямого действия на сердце.
 Дудник даурский
В эфирных маслах, выделенных из корней, содержится, 29 видов химических соединений, с наиболее высоким содержанием метилциклогексана, альфа-тетра-децилина, этиллаурата, а также содержатся кумарины и фурокумарины, фталиды, стероиды, лактоны.
По влиянию на центральную нервную систему обладает анальгетическим действием за счет увеличения порога болевой чувствительности, имеет значительное жаропонижающее действие по силе соответствующее 0,1 г/кг аспирина. Изоимператорин и мармезин, содержащиеся в корнях, обладают гипотензивным эффектом,
 Дудник китайский
Сырье содержит эфирные масла, фенольные и нейтральные соединения, кислоты: камфорную, анисовую, мускатную, различные аминокислоты, полисахариды, более 23 микроэлементов, а также витамины: В12, А, Е.
По влиянию на цнс обладает выраженным анальгетическим действием. Результаты эпидурального введения концентрированного раствора Дудника 14 пациентам с целью обезболивания показали, что по эффекту обезболивания и по продолжительности между Дудником и морфием (10 пациентов) оказались незначительные различия, токсического воздействия на пациентов и подопытных животных не обнаружено. В Китае препараты, изготовленные на основе Дудника широко применяются для лечения нарушений мозгового кровообращения.
При введении жидкого экстракта Дудника происходит замедление ЧСС, проявляется антиаритмическое действие, которое реализуется посредством удлинения рефрактерного периода миокарда, что по механизму действия и эффекту соответствует применению фелодипина в дозе 0,5 мг/кг. Эфирные масла Дудника оказывают фазное влияние на артериальное давление: кратковременное повышение сменяется плавным снижением, наблюдается сосудорасширяющее действие, которое не связано с влиянием на альфа- и бета-адренорецепторы, а обусловлено стимуляцией М и Н-холиновых рецепторов. Препараты Дудника снижают агрегацию тромбоцитов.
Гиполипидемическое действие Дудника связано с его активным компонентом — феруловой кислотой, которая тормозит синтез холестерина в печени.
 Любисток сычуаньский
Корень Любистка содержит эфирные масла, алкалоиды, лактоны и фенольные соединения.
Препараты Любистка в экспериментах на животных продемонстрировали анальгетический и седативный эффект, стимулирование рефлекторной активности сосудодвигательного центра продолговатого мозга, дыхательного центра. Введение отвара Любистка увеличивает амплитуду сокращений и замедляет сердечный ритм. Вытяжка и алкалоиды Любистка могут значительно расширять коронарные артерии, увеличивать коронарный кровоток, уменьшать ишемию, уменьшать высокое давление легочной вены и сопротивление легочных кровеносных сосудов, значительно увеличивать церебральный кровоток. Любистокцин продлевает время агрегации тромбоцитов, индуцированной эндогенным АДФ, а также оказывает антиагрегационное действие на уже адгезированные тромбоциты.
 Коричник китайский
Коричник содержит эфирные масла, основную часть которых составляет циннамальдегид. Кроме того, содержатся: циннамилацетат, этил-циннамат, бензилбензоат, бензальдегид, кумарин, каламенин.
По влиянию на цнс обладает седативным, противосудорожным, аналитическим действием за счет повышения порога болевой чувствительности и продления латентного периода болевой реакции. Коричное масло и коричный альдегид могут значительно продлевать латентный период судорог.
Отвар Коричника, в дозе 2 г/кг способен увеличивать коронарный и церебральный кровоток, тормозить агрегацию тромбоцитов, индуцированную аденозиндифосфатом и коллагеном.
 Эводия лекарственная
Химический состав: лимонин, рутаевин, эводол, обакунон, ацетатрутаевина. Также в сырье содержатся флавоноиды, алкины, стероидные соединения, жирные алифатические кислоты.
По влиянию на цнс компоненты обладают анальгетическим действием, которое реализуется за счет повышения порога болевой чувствительности и продления латентного периода болевой реакции. Раствор Эводии увеличивает ЧСС, уменьшает общее периферическое сосудистое сопротивление, проявляет гипотензивную активность.

Активированный уголь добавляется при изготовлении препарата в качестве формообразующего компонента, не является действующим веществом, так как содержится в концентрации, при которой не проявляется самостоятельное фармакологическое (сорбирующее) действие. Мед добавлен в препарат как формообразующее и повышающее адаптогенные способности организма вещество.
Помимо этого, компоненты, входящие в состав Болюсов Хуато обладают следующими эффектами:
Противовоспалительное действие: связано с активизацией коры надпочечников и системы гипофиз-кора надпочечников, снижением проницаемости капилляров, синтеза простагландина Е2 в очагах воспаления, стимуляцией фагоцитоза.
Влияние на жкт: стимуляция секреции желудочного сока, улучшение перистальтики, желчегонное действие, стимуляция кровотока в слизистой желудка, синтеза простагландинов; стимуляция синтеза ДНК, РНК в клетках печени; снижение повышенного давления в воротной вене; улучшение кровообращения в печени.
Влияние на углеводный обмен: активизация липолиза, индуцированного адреналином; ингибирование липогенеза, стимулируемого инсулином. В опытах на животных снижение глюкозы крови у кроликов, больных сахарным диабетом.
Влияние на иммунную систему: стимуляция функции фагоцитоза, стимуляция синтеза интерферона.
Антибактериальное: бактериостатическое действие на дизентерийную палочку, палочку брюшного тифа, пневмококки.
Другие свойства: торможение роста опухоли легких по Льюису (в экспериментах на животных), диуретический эффект.
Таким образом, уникальное сочетание, высокое качество и соотношение компонентов, входящих в состав препарата “Болюсы Хуато” обеспечивают эффективное действие по улучшению кровоснабжения и функционального состояния головного мозга.

Влияние препарата “Болюсы Хуато” на церебральный метаболизм по данным позитронно-эмисионной томографии
Институт Мозга Человек РАН, Санкт-Петербург

Особый интерес в плане понимания механизма действия препарата представляют данные ПЭТ-исследования с 18F-дезоксиглюкозой. У 7 пациентов (2 — последствия ишемического инсульта, 2 — ДЭ, 1 — последствия тяжелой ЧМТ, 1 — болезнь Альцгеймера, 1 — рассеянный склероз) получавших терапию Болюсами Хуато, отмечалось, как локальное, так и диффузное повышение скорости метаболизма глюкозы в головном мозге, что может говорить о выраженном неспецифическом ноотропном действии препарата.
В качестве иллюстрации приведены ПЭТ снимки больной Zh-a, перенесшей ишемический инсульт в бассейне левой средней мозговой артерии за 12 месяцев до начала терапии БХ с формированием в левом полушарии постинсультной кисты. (На верхних снимках — выраженный гипометаболизм в левом полушарии — чем более темное, тем ниже метаболизм глюкозы. На нижних снимках — улучшение метаболизма как вокруг кисты, так и диффузно во всем сером веществе головного мозга).
Zh-a, женщина 74 лет, диагноз: ишемический инсульт в бассейне ЛСМА, за 12 месяцев до исследования
Примечание: верхний ряд снимков — до лечения, нижний ряд снимков — после лечения
Больная К-а с дисциркуляторной энцефалопатией III стадии — до лечения выраженный диффузный гипометаболизм, особенно в правом полушарии, после лечения — значительное улучшение.
K-a, женщина 72 лет, диагноз: дисциркуляторная энцефалопатия III
Примечание: верхний ряд снимков — до лечения, нижний ряд снимков — после лечения
На графиках: данные об уровне потребления глюкозы в определенных областях интереса у тех же пациенток до лечения (before) и после лечения (after) сравниваются с 95%-ным доверительным интервалом уровня потребления глюкозы (верхняя граница (M+2sd) и нижняя граница нормы (M-2sd)), полученным по данным о здоровых добровольцах. По оси X — области интереса, по оси Y — отношение уровней накопления радиофармпрепарата в исследуемых областях и мозжечке (в процентах).
У больной Zh-a — До лечения практически все значения ниже нормы, больше это выражено в левом полушарии. После лечения кривая существенно повышается, достигая нормальных значений, как в зоне максимального поражения, т.е. вокруг кисты — левая лобная доля, (зоны интереса 7-11), так и в правой лобной доле (зоны интереса 35-43, 46-47).
Zh-a, женщина 74 лет, диагноз: ишемический инсульт в бассейне ЛСМА, за 12 месяцев до исследования
У больной К-а — До лечения кривая расположена на нижней границе нормы или не доходит до нее. После лечения отдельные области (передние и задние отделы поясной извилины — зоны интереса 13-14 и 46-47 соответственно, правая лобная доля — зоны интереса 36-40) доходят до нормальных значений. В целом кривая значений после лечения выше, чем до лечения.
K-a, женщина 72 лет, диагноз: дисциркуляторная энцефалопатия III
|